Total katastrofe
| RE: Equilibrium vs. Steady State01-10-2022 15:00 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev:John Niclasen skrev:Will there now be temperature gradients in the house? Jeg mener, det er korrekt at kalde dette sidste eksempel, hvor der ikke er energikilde inde i huset, for statisk, d.v.s. huset er i termodynamisk ligevægt. Det første eksempel med en energikilde i huset er så dynamisk, fordi der foregår en strøm af energi fra energikilden (heat source) til ydersiden af huset (heat sink), hvor energien så stråler væk. Ingen parametre ændrer sig, så det er steady state. Check: Difference between equilibrium and steady-state Video med forklaring: Equilibrium vs. Steady State @ YouTube Tilknyttet billede:  |
| RE: Eksempler kontra virkelighed01-10-2022 15:06 | |
| John Niclasen★★★★★ (6396) |
delphi skrev: Jeg har ændret syn på mit tankeeksperiment, så jeg vil ikke afvise temperaturgradienter i huset med en energikilde. Situationen betegnes som steady state, ikke termodynamisk ligevægt. Dermed var eksemplet nok ikke det bedste til at kaste lys over situationen på planeter som Jorden, og man er nok tilbage til at regne på Effektiv Temperatur og Lapse Rate, som jeg ved virker med eksempler for Jorden, Venus, og Titan. Eksempler kan dog kaste lys over teoretiske overvejelser. Man skal dog passe på med konklusioner, og det vil være aller-bedst med videnskabelige forsøg til at be- eller afkræfte hypoteser. |
| 01-10-2022 15:25 | |
| delphi (7581) |
Robert Wagner skrev:delphi skrev: Umiddelbart kan jeg ikke finde en tegning af absorptionsvarmpeprocessen. Men det virker kun når vanddampen absorberer ind i LIbr'en og volumen af Libr ikke ændres og vanddampen frigives ved et højere tryk i denne varmepumpefunktion. |
| 01-10-2022 16:24 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev: dette sidste eksempel, hvor der ikke er energikilde inde i huset, for statisk, d.v.s. huset er i termodynamisk ligevægt. Ja, jeg kan godt lide din beskrivelse. I dette nye tilfælde er det klart, at indgangsenergien er lig med udgangsenergien. Systemet vil nå en stabil tilstand ved en uniorm temperatur. |
| 01-10-2022 16:37 | |
| Robert Wagner★★★★★ (3520) |
delphi skrev:Robert Wagner skrev:delphi skrev: Så er det lidt svært at kommentere på det. Jeg ved bare at vanddamp anses som idealgas ved atmosfærisk tryk og lavere. Men det opfører sig ikke som idealgas ved højt tryk. Kølemidler i varme eller kølepumper opfører sig heller ikke som ideal gas. Men vi kom fra vanddamp i atmosfæren og der har vi atmosfærisk tryk og lavere. |
| 01-10-2022 18:04 | |
| delphi (7581) |
Robert Wagner skrev:delphi skrev:Robert Wagner skrev:delphi skrev: Ja det er selvsagt svært uden nogen dokumentation/illustrationer. Men hvis vand fordamper i en skål i et et lukket rum og der er fordampet 2 dm3 ved 20 C så fylder de over 10 m3 og når fordampningen sker er der ikke nogen luftturbulens omkring fordampningen, og det skyldes at dampen indføjer sig i luften via absorption og luftens rumfang stiger ikke. Redigeret d. 01-10-2022 18:04 |
| 01-10-2022 18:14 | |
| IBDaMann★★★☆☆ (999) |
delphi skrev:Ja det er selvsagt svært uden nogen dokumentation/illustrationer. 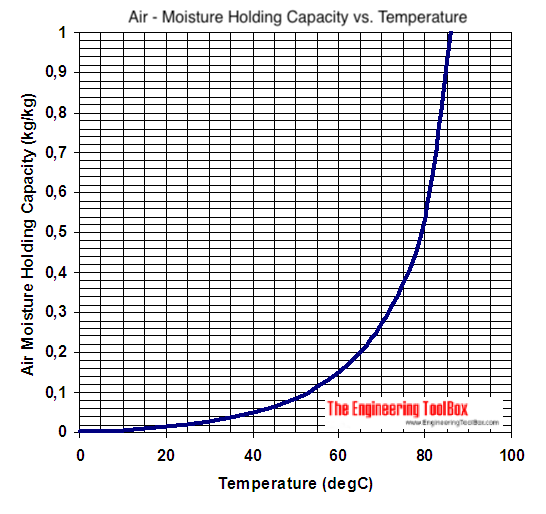 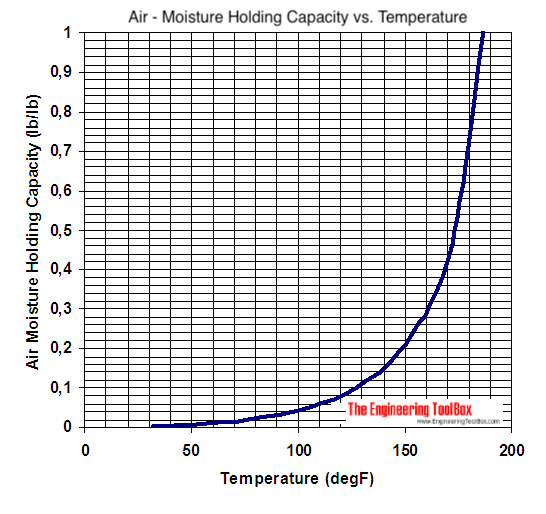 |
| 01-10-2022 18:15 | |
| delphi (7581) |
Eller 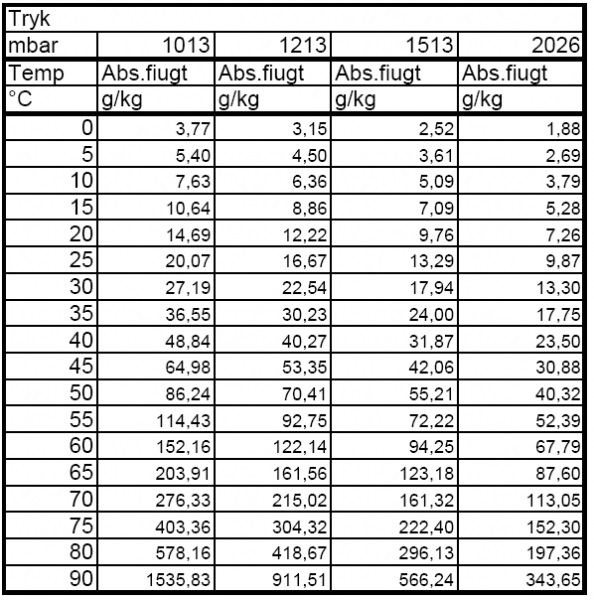 |
| 01-10-2022 19:48 | |
| Robert Wagner★★★★★ (3520) |
Det ændrer stadig ikke ved at vanddamp anskues som idealgas ved atmosfærisk tryk og lavere. |
| 02-10-2022 11:51 | |
| delphi (7581) |
Robert Wagner skrev: Bort set fra det, har den egenskaben, at det kan gå på damp ved lave temperaturer, når det absorberer ind i luften. Redigeret d. 02-10-2022 12:18 |
| 02-10-2022 13:19 | |
| Robert Wagner★★★★★ (3520) |
delphi skrev:Robert Wagner skrev: Ligesom de fleste væsker og faststoffer har et damptryk... Som f.eks. CO2 is, der kan fordampe ved temperaturer under CO2's frysepunkt. |
| 02-10-2022 13:27 | |
| delphi (7581) |
Robert Wagner skrev:delphi skrev:Robert Wagner skrev: Vand, co2 mf. kan det kun, hvis dampe kan absorberer ind i et medie. Ren vand og co2 i en lukket beholder, kan kun fordampe i henhold til damptabellerne. VAnds http://xqw.dk/Coppermine/displayimage.php?pid=754&fullsize=1 |
| 02-10-2022 13:52 | |
| Robert Wagner★★★★★ (3520) |
delphi skrev:Robert Wagner skrev:delphi skrev:Robert Wagner skrev: Så du mener vand ikke kan fordampe i et vakuum? |
| 02-10-2022 14:31 | |
| delphi (7581) |
Robert Wagner skrev:delphi skrev:Robert Wagner skrev:delphi skrev:Robert Wagner skrev: Det er da vist der damptabellen siger, at det kan. Men derimod hvis vanddamp kan absorbere ind i et medie, så kan det fordampe ved 20 C men ved 1 atm. Men derimod, ved 1 atm. kan ren vand uden absorptionsmulighed, kun koge ved 100 C. Redigeret d. 02-10-2022 14:32 |
| 02-10-2022 16:05 | |
| IBDaMann★★★☆☆ (999) |
delphi skrev:Det er da vist der damptabellen siger, at det kan. Men derimod hvis vanddamp kan absorbere ind i et medie, så kan det fordampe ved 20 C men ved 1 atm. Men derimod, ved 1 atm. kan ren vand uden absorptionsmulighed, kun koge ved 100 C. .Jeg forstår ikke forvirringen. Jo lavere trykket er, desto lavere er temperaturen, ved hvilken vand koger. Vand koger automatisk i et vakuum (som ikke har nogen temperatur eller tryk). Når trykket falder, falder vandets temperatur, og vandet koger, indtil det fryser. Vand kan nå et tri-punkt for at være en gas, væske og fast stof på samme tid. |
| RE: Vakuum har ikke temperatur02-10-2022 17:59 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev: Det bør gentages, at vakuum ikke har nogen temperatur! Vakuum er ikke et varmereservoir! Temperaturgradienter i atmosfærer er ikke temperaturgradienter mellem to varmereservoirer, som det er tilfældet med en husmur, hvor der typisk er varmt indenfor i det ene varmereservoir, og det er koldt udenfor i det andet varmereservoir. |
| 02-10-2022 23:11 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Det bør gentages, at vakuum ikke har nogen temperatur! Du tillader dig selv at blive distraheret over vilkårlige navne og definitioner. Jeg kan designe et system, der bruger et vakuum som et reservoir, hvori termisk stråling udsendes. Hvis du fortæller mig, at jeg er forpligtet til at kalde det noget andet, fordi det er et vakuum, er jeg måske ikke enig, og det vil ikke ændre mit system noget. Hvilket ord har du brug for til et varmereservoir, der er et vakuum? |
| RE: Varmereservoir og atmosfære03-10-2022 10:35 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev: Jeg gentager: et vakuum er ikke et varmereservoir! Et varmereservoir er en stor samling molekyler med en temperatur. Hvis du stikker et termometer med en lavere temperatur ind i et varmereservoir, så vil termometeret opnå samme temperatur som varmereservoiret. Hvis du stikker et termometer med en højere temperatur ind i varmereservoiret, så vil termometeret også opnå samme temperatur som varmereservoiret. Dette sker, fordi varmereservoiret er en meget stor samling molekyler, meget større end antallet af molekyler i termometeret. I praksis vil varmereservoiret selvfølgelig ændre temperatur uhyre lidt, når man fører det i kontakt med et termometer med en anden temperatur, men det er typisk så lidt, at man ikke kan måle det. Et vakuum er ikke en stor samling molekyler med en temperatur. Et vakuum kan indeholde stråling. Hvis man stråler energi til vakuumet, så kan man opfatte vakuumet som en heat sink. Hvis man netto modtager energi fra stråling i vakuumet, så kan man opfatte vakuumet som en heat source. Varmereservoirer bliver benyttet i forklaringen af heat engines: Energy Reservoir Model Og nu den vanskelige nød at knække: Temperaturgradienter mellem forskellige varmereservoirer er et velkendt fænomen, vi kender fra mange situationer på Jorden. Da vakuum ikke er et varmereservoir, så er temperaturgradienter gennem troposfæren ikke at sammenligne med temperaturgradienter mellem varmereservoirer. Temperaturgradienter i troposfæren, kendt som lapse rate, er der, uanset om atmosfæren hovedsaglig er opvarmet nedefra, som på Jorden, eller atmosfæren hovedsaglig er opvarmet oppefra, som på Venus. Lapse rate er i den simpleste form beskrevet ved formlen: - dT/dz = g/c_p , og den afhænger, som man ser på højre side af lighedstegnet, af tyngdeaccelerationen, g, lokalt og af den specifikke varmekapacitet af gassen, atmosfæren består af. Mit postulat er, at man ikke kan udnytte sådanne vertikale temperaturgradienter i atmosfærer til at udføre et mekanisk arbejde, som man kan med en heat engine og to varmereservoirer med forskellig temperatur. Redigeret d. 03-10-2022 10:53 |
| 03-10-2022 15:28 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:IBDaMann skrev:Hvilket ord har du brug for til et varmereservoir, der er et vakuum? Tak skal du have. Det er svaret på mit spørgsmål. Din præference er at kalde et vakuum for en "[køleplade]" og reservere "[varmereservoir]" for sagen ved en (relativt) fast temperatur. Jeg sætter pris på, at du præciserer dine vilkår. Vær opmærksom på, at nogle mennesker vil bruge "[varmereservoir]" til at betyde "[køleplade]", fordi det er en almindelig brug for et "[varmereservoir]". Bemærk også, at Google oversætter "[heat-reservoir]" til "[heat-sink]" eller "[heating-container]" eller noget andet, som ikke hjælper, så du skal muligvis afklare med ikke-dansktalende. . |
| 03-10-2022 15:42 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Temperaturgradienter mellem forskellige varmereservoirer er et velkendt fænomen, vi kender fra mange situationer på Jorden. Da vakuum ikke er et varmereservoir, så er temperaturgradienter gennem troposfæren ikke at sammenligne med temperaturgradienter mellem varmereservoirer. Jeg tror ikke, du kan sige dette. En temperaturgradient er en temperaturgradient. Det gør ikke noget, at der findes et mellem varmereservoirer og et findes i troposfæren. John Niclasen skrev:Mit postulat er, at man ikke kan udnytte sådanne vertikale temperaturgradienter i atmosfærer til at udføre et mekanisk arbejde, som man kan med en heat engine og to varmereservoirer med forskellig temperatur. Korrekt. En temperaturgradient er ikke et varmereservoir. |
| 03-10-2022 15:53 | |
| delphi (7581) |
Taler man kun om en gradient, hvis der flyttes energi mellem 2 varmereservoirer?? |
| 03-10-2022 16:19 | |
| IBDaMann★★★☆☆ (999) |
delphi skrev:Taler man kun om en gradient, hvis der flyttes energi mellem 2 varmereservoirer?? Absolut ikke. Temperaturgradienter findes overalt, hvor termisk energi strømmer gennem stoffet. Temperaturgradienter kan og bør altid genkendes. |
| RE: Temperaturgradient og tyngdefelt03-10-2022 16:30 | |
| John Niclasen★★★★★ (6396) |
En temperaturgradient betyder vel blot, at temperaturen er forskellig over en afstand. Temperaturen ændrer sig jævnt over afstanden. Det er vigtigt at forstå, hvad årsagen til temperaturgradienten er! Hvis temperaturgradienten er mellem to varmereservoirer, så skyldes gradienten, at de to reservoirer har forskellig temperatur. Energi vil strømme fra det varme reservoir til det kolde reservoir. Hvis temperaturgradienten er i den tætte del af en atmosfære (troposfæren), så skyldes gradienten, at det er en gas med en varmekapacitet i et tyngdefelt med tyngdeaccelerationen, g, som er forskellig for forskellige planeter og i forskellig afstand fra centrum af planeten. Der kan godt være temperaturgradienter i atmosfærer uden at der strømmer energi! Det er tæt på tilfældet i den nedre del af atmosfæren på Venus. Temperaturgradienten i atmosfærer er bestemt ved: - dT/dz = g/c_p dT/dz er størrelsen af gradienten (dT betyder ændring i temperatur dz betyder ændring i højde) g er tyngdeaccelerationen det pågældende sted (ændrer sig med højden) c_p er den specifikke varmekapacitet det pågældende sted (ændrer sig med temperatur og i mindre grad med tryk) |
| 03-10-2022 19:52 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:En temperaturgradient betyder vel blot, at temperaturen er forskellig over en afstand. Temperaturen ændrer sig jævnt over afstanden. En temperaturgradientfunktion vil ikke nødvendigvis være lineær (lige), men vil være kontinuerlig og differentierbar. John Niclasen skrev:Det er vigtigt at forstå, hvad årsagen til temperaturgradienten er! Ja. Temperaturgradienter er forårsaget af strømmende termisk energi. John Niclasen skrev:Der kan godt være temperaturgradienter i atmosfærer uden at der strømmer energi! Nej. Det er umuligt. Hvis der er en temperaturforskel, vil termisk energi flyde. Du kan ikke undgå termodynamikkens anden lov. |
| RE: Termodynamikkens 2. lov og tyngdefelter03-10-2022 20:53 | |
| John Niclasen★★★★★ (6396) |
Når der er et tyngdefelt, skal man tage højde for potentiel energi. Når atmosfæren er i termodynamisk ligevægt, så er situationen statisk. Et molekyle lavt i atmosfæren har mere kinetisk energi og mindre potentiel energi end et molekyle højt i atmosfæren, som har mindre kinetisk energi og mere potentiel energi. Samme slags molekyle har præcist samme totale mængde energi som ethvert andet af samme slags molekyle et andet sted i atmosfæren, når der er termodynamisk ligevægt. Man kan selv regne denne totale energi ud og se, at molekylerne har præcist samme totale energi, selvom der er forskellig temperatur. Man overbeviser bedst sig selv, hvis man selv foretager disse beregninger. Man kan evt. hente hjælp til at komme igang med disse beregninger ved at se i en anden tråd startende med dette indlæg: Adiabat 1 21-09-2016 12:27 Når molekyler bevæger sig op i tyngdefeltet, så mister de fart og dermed kinetisk energi, mens de får mere potentiel energi. Når molekyler bevæger sig ned i tyngdefeltet, så får de mere fart og dermed mere kinetisk energi, mens de mister potentiel energi. Når atmosfæren er helt i ro og i termodynamisk ligevægt, så flyder der netto ikke energi hverken op eller ned, selvom der er en temperaturgradient som beskrevet af lapse rate: - dT/dz = g/c_p Dette er ikke i strid med termodynamikkens 2. lov. Denne lov benyttes oftest til at fortæller om systemer, som er små nok til, at man kan se bort fra tyngdefelter, og derfor fører loven til samme temperatur overalt, når der er termodynamisk ligevægt. Dette er ikke tilfældet, når der er et tyngdefelt. |
| 03-10-2022 21:55 | |
| delphi (7581) |
Mit ræsonnement vedr. forløbet når varm mættet (vanddamp) luft stiger op ved ækvator, så er luften varm og energirig og herunder pga. vanddampen. 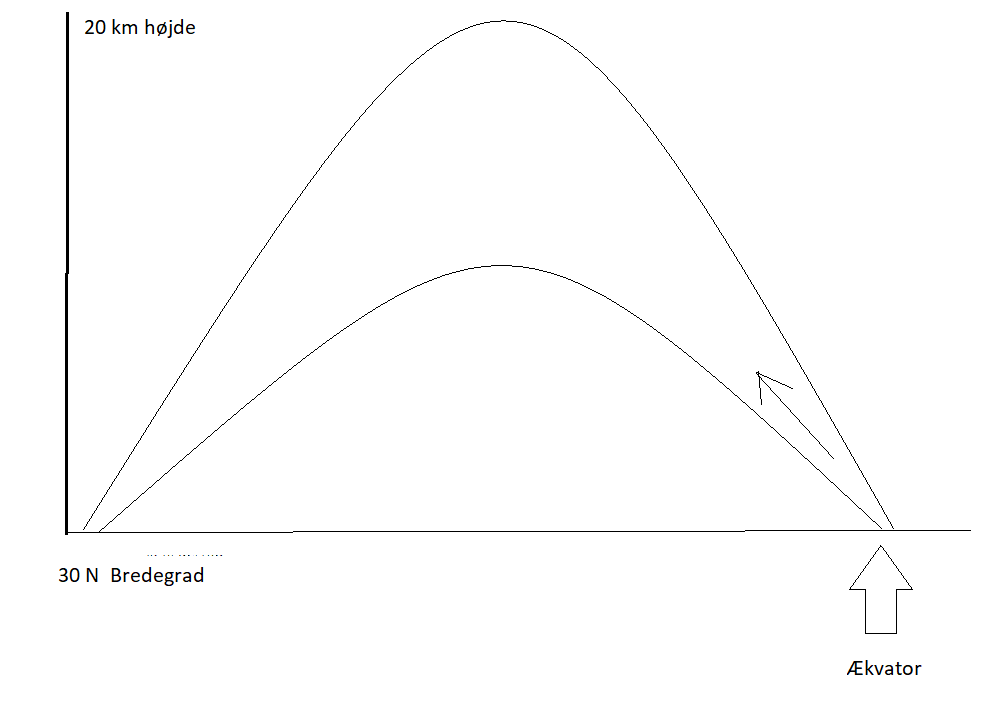 og når luftmolekylet har været oppe i op til 20 km højde og komme ned igen længere mod nord i disse Hadley celler, så er luften koldere og uden kondensatenergien og fylder det samme som da luftmassen steg op. Ergo må der være afsat termisk energi højt i atmosfæren. Og der oppe må denne energi være omsat til IR, og er strået ud i rummet. Redigeret d. 03-10-2022 21:56 |
| RE: Opvarmning af luft i atmosfæren03-10-2022 23:14 | |
| John Niclasen★★★★★ (6396) |
delphi skrev: Jeg er enig! Der er et mere simpelt eksempel uden vanddamp, som giver en idé om, hvad der sker. Når luft i atmosfæren varmes op, vil det forsøge at udvide sig. Trykket i den opvarmede luft er større end i den omkringliggende luft. Dette får luften til at stige til vejrs, mens det udvider sig. Udvidelsen får temperaturen i luften til at falde, mens det stiger til vejrs. Dette er en adiabatisk process, hvor der ikke tilføres eller fjernes varme fra luften, fordi det sker forholdsvis hurtigt. På et tidspunkt er trykket i den opvarmede luft igen lig med trykket i den omkringliggende luft, og det vil ikke længere stige til vejrs. Temperaturen i luften er lavere, end da det blev varmet op længere nede i atmosfæren, men den er stadig højere end den omkringliggende luft. Nu vil temperaturen falde i den opvarmede luft, indtil temperaturen er den samme (eller tæt på den samme) som i den omkringliggende luft. Dette er ikke en adiabatisk process, fordi der fjernes varme fra luften, som blev opvarmet. Energien bliver fordelt til omgivelserne. Man kan tydelig se opvarmningen, udvidelsen og stigen til vejrs, når man f.eks. ser en eksplosion. Energi transporteres effektivt fra den nedre til den øvre atmosfære ved konvektion. Jeg vil mene, at energi også kan transporteres fra den koldere øvre atmosfære til den varmere nedre atmosfære, hvis den øvre atmosfære opvarmes pludselig, så lapse rate bliver mindre end adiabatisk. Spredningen af energien vil oprette en adiabatisk lapse rate. Over tid vil det hele dog gå tilbage til situationen før opvarmningen, og lapse rate og en passende temperatur vil være genoprettet. Jeg gad vide, om der findes forsøg og/eller data fra observationer af dette. Tilknyttet billede: 
Redigeret d. 03-10-2022 23:17 |
| 04-10-2022 01:59 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Når der er et tyngdefelt, skal man tage højde for potentiel energi. Ikke til varmegradienter. Termisk energi påvirkes ikke af tyngdekraften. John Niclasen skrev:Når atmosfæren er i termodynamisk ligevægt, så er situationen statisk. Et molekyle lavt i atmosfæren har mere kinetisk energi og mindre potentiel energi end et molekyle højt i atmosfæren, som har mindre kinetisk energi og mere potentiel energi. Dette er ikke korrekt. Potentiel energi er ikke en faktor for luft i atmosfæren, og det er heller ikke en faktor for vand i havet eller snavs i jorden. John Niclasen skrev:Samme slags molekyle har præcist samme totale mængde energi som ethvert andet af samme slags molekyle et andet sted i atmosfæren, når der er termodynamisk ligevægt. Ukorrekt. Et CO2-molekyle, der har mere masse end et nitrogenmolekyle, vil således have mere termisk energi end et nitrogenmolekyle ved samme temperatur. John Niclasen skrev:Man kan selv regne denne totale energi ud og se, at molekylerne har præcist samme totale energi, selvom der er forskellig temperatur. Man overbeviser bedst sig selv, hvis man selv foretager disse beregninger. Man kan evt. hente hjælp til at komme igang med disse beregninger ved at se i en anden tråd startende med dette indlæg: De har forskellige niveauer af termisk energi ved samme temperatur. John Niclasen skrev:Når molekyler bevæger sig op i tyngdefeltet, så mister de fart og dermed kinetisk energi, mens de får mere potentiel energi. Det er helt forkert. Molekyler bevæger sig med hastigheden af vinden, der bærer dem. Lige nu er der nogle molekyler i mesosfæren med høj hastighed, mens der er nogle molekyler i bunden af atmosfæren, der i det væsentlige er stationære. Din erklæring er forkert. John Niclasen skrev:Dette er ikke i strid med termodynamikkens 2. lov. Denne lov benyttes oftest til at fortæller om systemer, som er små nok til, at man kan se bort fra tyngdefelter, og derfor fører loven til samme temperatur overalt, når der er termodynamisk ligevægt. Dette er ikke tilfældet, når der er et tyngdefelt. Alle termodynamiklove gælder, uanset om der er tyngdekraft eller ej. |
| RE: En formel05-10-2022 09:22 | |
| John Niclasen★★★★★ (6396) |
.
Tilknyttet billede:  |
| RE: Tyngde er ikke en kraft05-10-2022 10:45 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev: Du bør undlade at skrive "tyngdekraft" på dansk, hvis du har som mål at være videnskabelig. Det skyldes sikkert, at du har benyttet en oversættelse fra det engelske "gravity". "Tyngde" betyder "gravity" på engelsk, så benyt ordet "tyngde", hvis du mener "gravity". "Tyngdefelt" er "gravity field" på engelsk, hvilket også er en ok betegnelse. "Kraft" kommer fra tysk og betyder "force" på engelsk. Vi har vidst i over 100 år, at tyngde ikke er en kraft. Redigeret d. 05-10-2022 10:46 |
| RE: Samme slags molekyler05-10-2022 10:50 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev:John Niclasen skrev:Samme slags molekyle har præcist samme totale mængde energi som ethvert andet af samme slags molekyle et andet sted i atmosfæren, når der er termodynamisk ligevægt. Jeg skrev "samme slags", hvilket på engelsk er "same kind of". Du snakker om forskellige molekyler, hvilket bevirker, at dit svar bliver nonsens. Din påstand om, at mine sætninger er "ukorrekt" er i sig selv ukorrekt. |
| RE: Undvigelseshastighed og molekylehastigheder05-10-2022 11:30 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev:John Niclasen skrev:Når molekyler bevæger sig op i tyngdefeltet, så mister de fart og dermed kinetisk energi, mens de får mere potentiel energi. Hvis molekyler bevæger sig med hastigheden af vinden, hvorfor er der så nærmest intet hydrogen i atmosfæren på Saturns måne, Titan, mens Saturn har mere end 96% hydrogen i sin atmosfære? Og hvorfor har de øvrige mindre måner omkring Saturn nærmest ingen atmosfære? Hvorfor har vores Måne nærmest ingen atmosfære, mens Jorden har atmosfære? De befinder sig (er dannet) samme sted i Solsystemet. |
| RE: En formel05-10-2022 11:47 | |
| John Niclasen★★★★★ (6396) |
.
Tilknyttet billede: 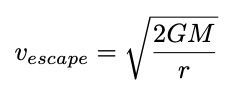 |
| 05-10-2022 15:24 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Du bør undlade at skrive "tyngdekraft" på dansk, hvis du har som mål at være videnskabelig. Jeg sætter pris på dine tips om formuleringer på det danske sprog. Hvis du vil være mere videnskabelig, skal du ikke være så hurtig til at tro på alt, hvad du er beordret til at tro. Vær i stedet hurtig til at bruge uafhængige, kritiske ræsonnementer. Vi har vidst, at tyngdekraften er en kraft, siden Newton forklarede det. Vi ved, at Newton var, og stadig er, korrekt, fordi ingeniører med succes bruger Newtons model til at bygge systemer, der virker. Jeg anbefaler stærkt, at du lærer, hvad videnskab er. Du vil finde det nyttigt. |
| 05-10-2022 15:32 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:IBDaMann skrev:John Niclasen skrev:Når molekyler bevæger sig op i tyngdefeltet, så mister de fart og dermed kinetisk energi, mens de får mere potentiel energi. Tilstedeværelsen eller manglen på en atmosfære, eller sammensætningen af en given atmosfære, er irrelevant for sagen. Atmosfærens molekyler bevæger sig med hastigheden af vinden, der bærer dem. |
| RE: Hvad er videnskab og tyngde?05-10-2022 16:11 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev:John Niclasen skrev:Du bør undlade at skrive "tyngdekraft" på dansk, hvis du har som mål at være videnskabelig. Jeg er glad for at kunne hjælpe. Hvis du vil være mere videnskabelig, skal du ikke være så hurtig til at tro på alt, hvad du er beordret til at tro. Vær i stedet hurtig til at bruge uafhængige, kritiske ræsonnementer. Jeg er ikke beordret til at tro på noget af det, jeg skriver. Tværtimod! Jeg påpegede for underviser på "Fysik 1" universitets-kurset omkring mekanik, at tyngde ikke er en kraft, da man ikke kan måle den, men at derimod normalkraften, vi også lærte om, er en virkelig kraft, da man kan måle den. Han forstod ikke, hvad jeg sagde. Han påstod, man kan mærke tyngdekraften, når man hopper ned fra et hustag. På et senere kursus i astronomi oplevede jeg en anden underviser gå i mental loop og blive ved med at gentage "Hvad får papiret til at falde på gulvet? Hvad får papiret til at falde på gulvet? ..." (han slap nogle ark papir, han havde i hånden), da jeg også her påpegede, at tyngdekraften er fiktiv. Så nej, jeg er bestemt ikke beordret til at tro. Jeg tænker, benytter den videnskabelige metode, og jeg har viden. Tyngdekraften er fiktiv, ligesom centrifugalkraften er fiktiv. Vi har vidst, at tyngdekraften er en kraft, siden Newton forklarede det. Aha! Det lyder som om, at du mener, man kan bevise rigtigheden af videnskabelige teorier? Det kan man ikke. Man kan falsificere videnskabelige teorier. Og/eller det lyder som om, at du mener, videnskab er bestemt ved konsensus!? Hvis Newton havde skrevet ind i Principia, at centrifugalkraften var en rigtig kraft, havde du så også troet på det? Det siges, bl.a. Hooke fik overbevist Newton om, at centrifugalkraften er fiktiv, og at centripetalkraften er virkelig. Vi ved, at Newton var, og stadig er, korrekt, fordi ingeniører med succes bruger Newtons model til at bygge systemer, der virker. Kan du vise nogle af de beregninger med tyngdekraft, som ingeniørerne benytter til at bygge systemer? Jeg anbefaler stærkt, at du lærer, hvad videnskab er. Du vil finde det nyttigt. Ditto! |
| RE: Atmosfærer, molekylehastigheder, og vind05-10-2022 16:15 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev: Jeg er uenig! Jeg kan forklare manglen på atmosfære og sammensætningen af en given atmosfære ved hjælp af kendskabet til molekylehastigheder. Så det er meget relevant for sagen. Atmosfærens molekyler bevæger sig med hastigheden af vinden, der bærer dem. Hvad består denne vind af, som du henviser til? Er det en uforklarlig magisk ting, eller har den en forklaring, jeg ikke er bekendt med? |
| RE: Molekyler, vind, og absolut nulpunkt05-10-2022 16:41 | |
| John Niclasen★★★★★ (6396) |
IBDaMann skrev: Jeg kunne også spørge, hvilken hastighed bevæger molekylerne sig med, når der er vindstille? Hvis de ligger stille, som du antyder, hvilken hastighed har molekylerne så, hvis vi derefter køler dem ned til nær det absolutte nulpunkt, 0 Kelvin? Eller måske du mener, at molekylerne har en temperatur på 0 Kelvin, når det er vindstille? |
| 05-10-2022 17:37 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Jeg er ikke beordret til at tro på noget af det, jeg skriver. Tværtimod! Jeg påpegede for underviser på "Fysik 1" universitets-kurset omkring mekanik, at tyngde ikke er en kraft, da man ikke kan måle den, men at derimod normalkraften, vi også lærte om, er en virkelig kraft, da man kan måle den. Han forstod ikke, hvad jeg sagde. Han påstod, man kan mærke tyngdekraften, når man hopper ned fra et hustag. På et senere kursus i astronomi oplevede jeg en anden underviser gå i mental loop og blive ved med at gentage "Hvad får papiret til at falde på gulvet? Hvad får papiret til at falde på gulvet? ..." (han slap nogle ark papir, han havde i hånden), da jeg også her påpegede, at tyngdekraften er fiktiv. Så nej, jeg er bestemt ikke beordret til at tro. Jeg tænker, benytter den videnskabelige metode, og jeg har viden. Aha! Det lyder som om, at du mener, man kan bevise rigtigheden af videnskabelige teorier? Det kan man ikke. Man kan falsificere videnskabelige teorier. Og/eller det lyder som om, at du mener, videnskab er bestemt ved konsensus!? Du ville have gavn af at lære, hvad videnskab er, og ved at lære, hvad den videnskabelige metode er. Newton leverede en model for tyngdekraften. Denne model har en svaghed: den gælder kun inden for en enkelt inertiereferenceramme. Einstein skabte en model, der spænder over flere inertiereferencerammer. I Einsteins model er tyngde ikke en kraft, men derimod en krumning af rum-tid. Hvis du taler om en enkelt inertiel referenceramme, er Newtons model ikke bevist forkert. Det betyder, at du ikke har vist, at det er forkert. John Niclasen skrev:Hvis Newton havde skrevet ind i Principia, at centrifugalkraften var en rigtig kraft, havde du så også troet på det? Du ville have gavn af at lære, hvad videnskab er. Du tror fejlagtigt, at det er et trossystem. Du tror fejlagtigt, at det er en religion. En videnskabsmodel er en falsificerbar model, der forudsiger naturen. Newton definerede en kraft som den, der accelererer massen. Ergo, hvis du observerer en masse accelererende (med fokus på en inertiereferenceramme), så observerer du (virkningerne af) en kraft. Det er ikke kun en tro; det er videnskab. Det er op til dig at vise, at det er falsk. |
| 08-10-2022 01:11 | |
| delphi (7581) |
Hvis man ser på gasligningen, og ser på rumfanget op gennem atmosfæren, når varme luftmasser stiger i lufthavet. Nu er det da lige til at forstå, at det varme luftmolekyle afsætter potentiel energi, når molekylet løftes i atmosfæren. Det kan da ikke være anderledes. Forholdet på Venus gør da dette forhold meget letforståelig, se 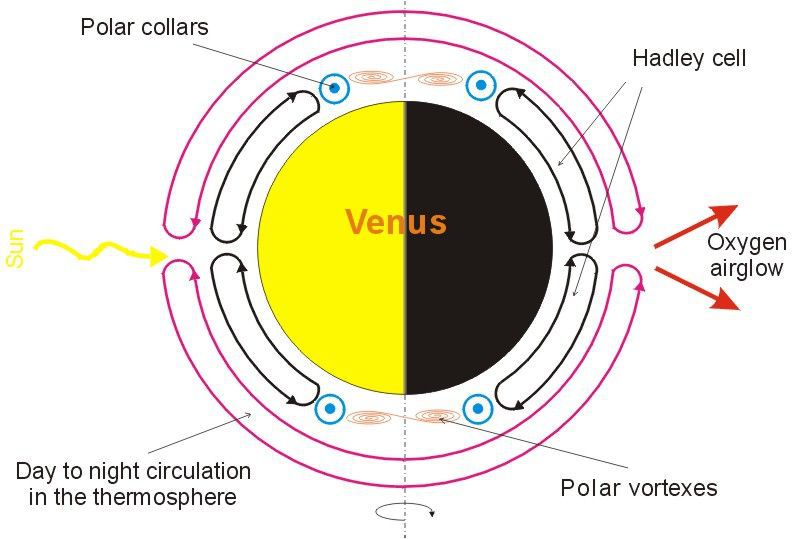
Redigeret d. 08-10-2022 01:13 |
Deltag aktivt i debatten Total katastrofe:
Lignende indhold
| Debatter | Svar | Seneste indlæg |
| Katastrofe for oss alle | 0 | 27-07-2023 16:35 |
| Støv og partiklers fordeling, total masse og volumen, der lander fra luften alle lokale steder i Danmark. | 5 | 13-06-2018 17:10 |
| Glyphosat er en katastrofe i Agentina , der forties af Dansk Landbrug... | 55 | 30-11-2017 11:09 |
| Katastrofe | 0 | 01-12-2012 16:21 |
| Thule-bomben: Klima-katastrofe? | 15 | 10-12-2009 10:21 |
| Artikler |
| Katastrofer |