Hvad fortæller Venus os om CO2 som drivhusgas på Jorden? IGEN !
| 18-10-2016 20:26 | |
| Kjeld Jul★★★★★ (3888) |
kulden-varmen skrev:Kjeld Jul skrev: Praktisk den samlede IR energi der er absorberet af CO2 bliver termaliseret dvs.sammenstød mellem CO2 molekylerne og andre luftmolekyler bliver forvandlet til kinetisk energi. Af den grund er en direkte varme tilbagestråling til jordoverfladen så godt som udelukket. |
| 18-10-2016 23:40 | |
| kulden-varmen (2597) |
Kjeld Jul skrev:kulden-varmen skrev:Kjeld Jul skrev: Dette er rigtigt, men kun ved høj tryk. |
| 18-10-2016 23:59 | |
| John Niclasen★★★★★ (6434) |
Man må forholde sig til, hvad man kan måle. Flg. spektra er fra dette indlæg.  |
| 19-10-2016 08:00 | |
| N A Nielsen★★★☆☆ (991) |
Ok, du famler efter halmstrå og finder nogen skyer og noget dis som pludselig i din N2 atmosfære skulle kunne levere drivhuseffekt, så temperaturen kan stige 450K ved overfladen.....John Niclasen skrev: ?? Foreslår du at N2 gassen er 1180K ved overfladen mens selve overfladen skulle have en anden temperatur? Ellers forstår jeg ikke, hvad du antyder. Udstrålingen er stadig proportional med temperaturen i fjerde, selvom overfladen ikke er et sort legeme. Redigeret d. 19-10-2016 08:10 |
| 19-10-2016 20:11 | |
| Kjeld Jul★★★★★ (3888) |
[quote]John Niclasen skrev: Man må forholde sig til, hvad man kan måle. Flg. spektra er fra dette indlæg.  [/quote [/quoteBeregninger viser,at en typisk atmosfære med et normalt partialtryk for CO2 og med 50 procent vanddamp mætning allerede efter en vejlængde på 100m,har absorberet 72,8% af strålingen fra jordoverfladen.Fordobler man i denne atmosfære CO2 indholdet,forhøjes absorptionen kun fra 72,8 til 73,5%.Denne lille stigning viser,hvor tæt den såkaldte drivhuseffekt er på en mætning med den tilstedeværende vanddamp. Redigeret d. 19-10-2016 20:12 |
| 20-10-2016 08:44 | |
| N A Nielsen★★★☆☆ (991) |
Erstatter man CO2 med N2 med samme masse i Venusatmosfæren, vil overfladens temperatur ifølge John N og hans model stige til 1180K. Svarende til, at overfladen nu skulle udstråle 6-7 gange mere energi end før. Hvor kommer energien fra? Drivhuseffekten fra CO2 er fjernet og temperaturen stiger? |
| 20-10-2016 09:02 | |
| John Niclasen★★★★★ (6434) |
Kjeld Jul skrev: På den virkelige Venus er der 737 K nede ved den faste overflade, og den effektive temperatur findes i min model ved et tryk på 0.21 bar i knap 59 km højde, hvilket ikke er så langt fra virkeligheden. N2 har en lavere massetæthed end CO2. Således vejer N2 28 gram/mol, hvor CO2 vejer 44 gram/mol. Dvs. der skal mange flere molekyler til at have de samme 92 bar nede ved den faste overflade med 100% N2, som når man har 96.5% CO2. (Jeg ser bort fra sporgasser, som bl.a. danner skyer.) Atmosfæren vil umiddelbart fylde meget mere ved samme temperatur. Man er umiddelbart nødt til at gætte på en af størrelserne, og så se, hvad der sker. Her er nogle resultater: ---- Hvis vi først antager, at temperaturen nede ved den faste overflade er uændret 737 K, så kommer jeg frem til, at den effektive temperatur for Venus, 226.6 K vil findes ved 1.4 bar i godt 61 km højde. Der vil altså være en betydelig mængde atmosfære højere oppe end denne højde. ---- Hvis vi antager, at de 226.6 K skal findes ved 0.21 bar, som er tæt på virkeligheden med CO2, så vil dette være i knap 120 km højde, og der vil være knap 1180 K nede ved den faste overflade. Dette virker umiddelbart ikke så sandsynligt. ---- Hvis vi antager, at temperaturen nede ved den faste overflade vil falde med 420 grader til 317 K, som foreslået i artiklen af Titov et al., så vil de 226.6 K findes i knap 11 km højde, hvor trykket vil være godt 28 bar. De 0.21 bar, der ca. er grænsen for troposfæren, vil i dette tilfælde findes i knap 31 km højde, hvor temperaturen vil være 56 K. Det er så koldt, at man skal til at tænke på, om N2 vil fryse til is. Jeg finder ikke umiddelbart dette plausibelt heller. Jeg vil fortsat undersøge disse ting og udbygge min model. Så må vi se, om der dukker noget bedre op. |
| 20-10-2016 17:13 | |
| N A Nielsen★★★☆☆ (991) |
John:Hvis vi antager, at temperaturen nede ved den faste overflade vil falde med 420 grader til 317 K, som foreslået i artiklen af Titov et al., så vil de 226.6 K findes i knap 11 km højde, hvor trykket vil være godt 28 bar. De 0.21 bar, der ca. er grænsen for troposfæren, vil i dette tilfælde findes i knap 31 km højde, hvor temperaturen vil være 56 K. Det er så koldt, at man skal til at tænke på, om N2 vil fryse til is. Jeg finder ikke umiddelbart dette plausibelt heller. Med andre ord kan Johns "model" ikke sige noget som helst om temperaturen af en planet udfra sammensætningen af dens atmosfære. Det kan Titov et al. Det kan de fordi de kan regne på drivhuseffekten (radiative transfer equations). Det hverken kan eller vil John. Han vil hellere gætte og antage, for så kan han nemlig sætte de her mere eller mindre tilfældige værdier ind i sin model og vurdere, om resultatet sådan lyder "plausibelt" eller "sandsynligt"...... En temperaturstigning på 450K til 1180K ved Venusoverfladen, når CO2 erstattes med samme masse af den IR-transparente gas N2, synes du lige pludselig ikke lyder sandsynligt. Hvad blev der af dine henvisninger til skyer, tåge og energi fra radiaktivt henfald? Redigeret d. 20-10-2016 17:24 |
| 05-01-2019 15:41 | |
| UlrikePielmeier★☆☆☆☆ (117) |
Hej, Er det i orden, at jeg genåbner denne tråd? Jeg er newbie her og har et par spørgsmål, men jeg håber på svar i en ikke nedtalende omgangstone. Det kan også være at nogen her eller i den forrige tråd har besvaret før - om forladelse, jeg har prøvet at sætte mig ind i trådens diskussionsemner, men har ikke læst alle debatindlæg. 1. Er der kommet noget væsentligt nyt om klimaet og green house effekten på Venus, siden debattens slutning og Ib Lundgaard Rasmussens indlæg Klumme Ib Lundgaard Rasmussen Klimaet på Venus? 2. Nikolov-Zeller har udviklet en makro model om temperatur og atmosfærisk tryk, som kan med meget høj nøjagtighed forklare en (i modellen konstant antaget) gennemsnits surface temperatur på vores solsystems planeter med fast overflade, såsom Venus, Mars, osv... På en måde en skønt og meget indlysende model, men Anthony Watts er grundlæggende meget uenig med deres teori: Giving credit to Willis Eschenbach for setting the Nikolov-Zeller-silliness straigt Jeg har ikke læst artiklen, må jeg indrømme. Jeg har i stedet for set deres conference bidrag, som er her på video: The London conference on climate change Sep 2016 Er det ikke kun et spørgsmål om scale, eller diskuterer vi virkelig om drivhuseffekten ikke findes ifølge Nikolovs (makro-scale) model, eller er den bare så insignifikant lille i det hele taget, men har den nogen signifikans når man går ned på en planet's micro scale? |
| 06-01-2019 10:21 | |
| kulden-varmen (2597) |
UlrikePielmeier skrev: OK. Jordens overflade temperatur på havoverfladens ved ækvator variere, men ligger imellem 15'C og 24'C, normalt o. 16'C. Denne temperatur skyldes at det varme saltholdige vand synker til bunden når det bliver 24'C grader varmt. Det er på den måde at Jorden har haft et nogenlunde stabilt klima i de sidste miliarder af år. Når Venus har så høje temperature på overfladen så skyldes det at ved den temperatur fordamper svovl. Det vil sige at overfladen af Venus er afkølet med svovl. Det store forskel imellem Jorden og Venus kan bedst forklares ved at solen havde en kold periode inden at den begyndte at lyse rigtigt. Og i denne periode var Mars, Jorden og Månen dægget med is fra små kometnedslag og støv fra komethaler. I Venus's banen har solen vært stærk nok til at de mange små kometer fordampede. Den gamle grå overflade på månen er måske resterne af det oprindelige isdække. For at Jorden kan få et klima som Venus så skal verdenshavene først udtørres. Så der kun er er svovl som virker afkølende på overfladen. Dette er ikke særligt sandsynligt når verdenshavene er 4km dybe. |
| 06-01-2019 15:49 | |
| yaknudsen★☆☆☆☆ (137) |
kulden-varmen skrev:UlrikePielmeier skrev: Nixenbixen. Det er korrekt at vandet i oceanerne har en stabiliserende effekt på luftens temperatur. Resten af ovenstående udsagn er decideret fordrukkent pølsesnak uden sammenhæng med virkeligheden. Vand er tungest ved ca. +4 grader celcius, og vandtemperaturen i dybhavet (ved vanddybder fra ca. 1.500 meter og nedad) ligger derfor konstant på ca. +4 grader celcius. Det gælder overalt på kloden, også i troperne (med undtagelse af de (meget små og få) lokaliteter hvor der findes stærk omrøring i dybhavet eller der findes geotermisk påvirkning). https://en.wikipedia.org/wiki/Thermocline [/quote] kulden-varmen skrev: Virkelig? https://en.wikipedia.org/wiki/Atmosphere_of_Venus kulden-varmen skrev: Desværre mere fordrukkent pølsesnak. En uigennemtænkt tankerække uden nævneværdigt hold i virkeligheden, pølsesnak der ikke bidrager til forståelse, men derimod bidrager til misinformation og irritation. Kulden-varmen = 90% pølsesnak og 100% spild af opmærksomhed. Redigeret d. 06-01-2019 15:51 |
| RE: Adiabat17-05-2023 17:32 | |
| John Niclasen★★★★★ (6434) |
Grafer gemt via tinypic er desværre forsvundet, og de mangler nu i tidligere indlæg. Jeg vil derfor gentage tidligere indlæg fra 2016 om forklaring af begrebet adiabat og en model, jeg benytter, når jeg regner på planetatmosfærer. |
| RE: Adiabat 117-05-2023 17:34 | |
| John Niclasen★★★★★ (6434) |
Adiabat 1 For at beskrive en adiabatisk process, så tager man fat i loven om energibevarelse. Og vi skal have fat i den udgave, man benytter i termodynamikken kaldet termodynamikkens 1. lov: dU = dQ + dW Den siger, at ændringen i energi, U, er lig ændringen i varme, Q, plus ændringen i arbejde, W, omgivelserne udfører på systemet. For en adiabatisk process er ændringen i varme nul. Der bliver ikke tilført eller frigivet varme. Dette kan være tilfældet med gasser, der er dårlige til at lede varme. Så har vi blot: dU = dW, da dQ er nul. Nu kan man så gå igang med at se på hvor meget energi, der er involveret. Når en gas trykkes sammen, så er arbjedet givet ved: p * dV, hvor p er trykket, og dV er en lille ændring i volumen. Men hvis vi flytter 1 kg gas fra 1 bar på Venus ned til overfladen, hvor der er 92 bar, så ændrer trykket sig jo. Hvad gør man så? Man finder ud af, hvordan trykket ændrer sig på vejen ned, tegner et pV-diagram og finder arbejdet som arealet under grafen. Altså en integration. Flg. pV-diagram har jeg dannet for et eksempel med en helt igennem adiabatisk process mellem 1 og 92 bar. Resultaterne kan man jo så sammenligne med den virkelige Venus. Det grå område er arbejdet. 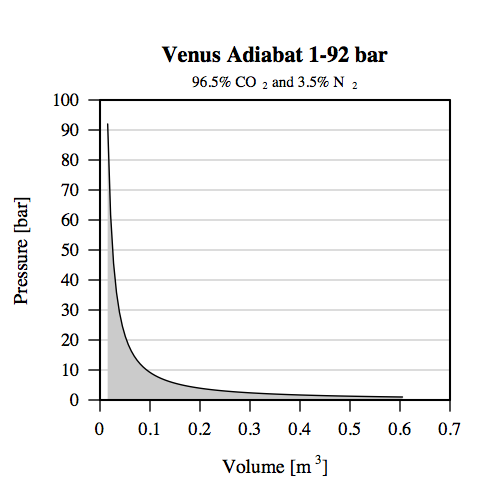 Det er den omkringliggende atmosfære, der udfører dette arbejde på vores 1 kg gas, så det presses sammen. Omvendt må vi så have 1 kg gas, der bevæger sig den anden vej, og denne gas vil udvide sig, dvs. den udfører et tilsvarende arbejde på atmosfæren, så der hverken går energi ind eller ud af systemet totalt set. Gas, der bevæger sig op og ned i troposfærer, kendes fra konvektion. Hvis du vil se fysikken beskrevet i en bog, og gerne en ældre en af slagsen, som du efterspørger, så kan jeg anbefale Enrico Fermi's bog "Thermodynamics" fra 1957 efter arbejde først udgivet i 1937. Den kan findes på nettet, søg blot på "Enrico Fermi Thermodynamics". Der er også et afsnit, hvor han gør noget lign. for Jordens atmosfære og beregner en temperaturgradient. |
| RE: Adiabat 217-05-2023 17:36 | |
| John Niclasen★★★★★ (6434) |
Adiabat 2 Termodynamikkens 1. lov er for en adiabatisk proces: dU = dW, da ændringen i varme, dQ, er nul. Ændringen i arbejdet blev fundet som (-p * dV), og på samme måde kan man finde ændringen i indre energy, dU, som (C_V * dT), hvor C_V er varmekapaciteten for konstant volumen (kaldet isokor varmekapacitet), og dT er en lille ændring i temperatur. Men varmekapaciteten for CO2 (og de fleste andre gasser) ændrer sig med temperaturen, så ligesom ved arbejdet er man nødt til at integrere. Man plotter varmekapaciteten som en funktion af temperaturen, og så er ændringen i den indre energi arealet under grafen. Vedhæftede plot viser både den specifikke varmekapacitet for atmosfæren på Venus for konstant volumen og konstant tryk som funktion af temperaturen. (Den isobare varmekapacitet for konstant tryk skal vi bruge senere.) Da vi ser på 1 kg gas i dette eksempel, så bliver den endelige varmekapacitet det samme som vist. Inden vi ser på værdier, så kan vi altså angive termodynamikkens 1. lov for en adiabatisk proces som: dU = dW <=> C_V * dT = -p * dV , og der skal altså integreres på begge sider for at få de endelige værdier, fordi varmekapaciteten ændrer sig med temperaturen, og fordi trykket ændrer sig med volumen. Tilknyttet billede: 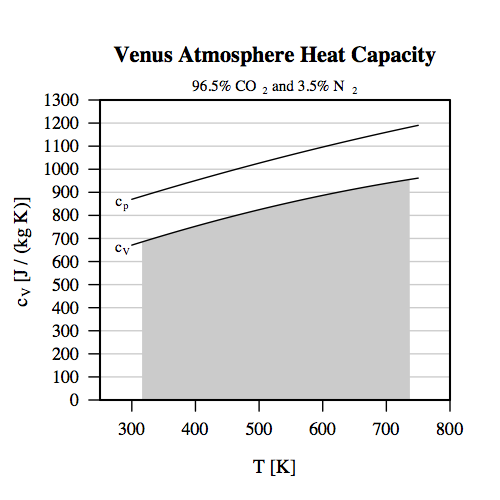
Redigeret d. 17-05-2023 17:44 |
| RE: Adiabat 317-05-2023 17:37 | |
| John Niclasen★★★★★ (6434) |
Adiabat 3 Termodynamikkens 1. lov kan udtrykkes: dU = dQ + dW , hvor dU er ændring i indre energi, dQ er tilført varme, og dW er ændring i arbejde, omgivelserne udfører på systemet, man ser på. For en adiabatisk proces er tilført varme nul, og derfor får vi: dU = dW , som kan skrives som: C_V * dT = -p * dV I dette eksempel med 1 kg gas i atmosfæren på Venus bestående af 96.5% CO2 og 3.5% N2, regner jeg arbejdet ud til ca. 353 kJ. Og jeg har fundet ændringen i indre energi til at være ca. 351 kJ. Den lille forskel, som er på 3. decimal skyldes usikkerheder i de angivne værdier, f.eks. for varmekapaciteten. Regnskabet stemmer med andre ord! Der er ikke nogen anden energikilde. Når man har en gas i et tyngdefelt, som i dette eksempel med tryk på 1 bar øverst og 92 bar nederst (og med et temperaturændring fra 316 K til 737 K), og når gassen bevæger sig mellem disse to tilstande, så er der godt 350 kJ mere indre energi nederst ved 92 bar, end øverst ved 1 bar. Næste punkt er så at se på, hvad disse godt 350 kJ ekstra indre energi betyder for temperaturen, og i relation til varmekapaciteten. Og vi skal se på, hvordan dette hænger sammen med forskellen i potentiel energi. |
| RE: Adiabat 417-05-2023 17:39 | |
| John Niclasen★★★★★ (6434) |
Adiabat 4 Jeg kom frem til, at der blev udført et arbejde på godt 350 kJ af den omgivende atmosfære på det 1 kg gas i dette eksempel. Arbejdet blev regnet ud til 353 kJ, og ændringen i den indre energi blev regnet ud til 351 kJ. Lad os tage 352 kJ til videre beregning. Det er ikke al denne energi, man kan måle som temperatur. Gassen består for det meste af CO2, et molekyle som både kan rotere og vibrere ud over at bevæge sig i tre dimensioner, x, y, og z. En del af gassen er N2, som kan rotere og bevæge sig i tre dimensioner. Det er kun bevægelse, altså den kinetiske energi, man kan måle som temperatur, ikke de indre rotationer og vibrationer. Bevægelse kaldes også translation. Varmekapacitet er et mål for frihedsgraderne i molekylerne. Det er en sum af translation, rotation og vibration. Der er altid translation for alle molekyler i en gas. Det er meget nemt at rotere et molekyle, så der er også altid rotation for de molekyler, der kan rotere - altså har en udstrækning, fordi molekylet består af flere atomer. Vibration opstår for nogle molekyler ved højere energier, højere temperaturer. Det er derfor, varmekapaciteten afhænger af molekylernes opbygning og af temperaturen (og i mindre grad også af trykket). Den kinetiske energi er givet som E_kin = 1/2 * m * v^2 , hvor m er massen og v er hastigheden. Hastigheden af molekylerne i en gas følger en Maxwell-fordeling, hvor den gennemsnitslige hastighed er givet ved v = sqrt (3 * R * T / M) , hvor R er gaskonstanten, T er temperatur og M er molmassen, som er 43.45e-3 kg/mol i dette eksempel. Ved en temperatur på 737 K bliver hastigheden: v = sqrt (3 * R * 737 K / 43.45e-3 kg/mol) = 650 m/s Dermed bliver den kinetiske energi for 1 mol: E_(kin, mol) = 1/2 * 43.45e-3 kg/mol * (650 m/s)^2 = 9 kJ I 1 kg gas bestående af 96.5% CO2 og 3.5% N2 er der 1 kg / 43.45e-3 kg/mol = 23 mol. Dermed bliver den totale kinetiske energi for 1 kg: 9 kJ * 23 = 212 kJ (Jeg runder af i de viste tal, men jeg benytter alle cifre i beregningerne.) Ved 1 bar var temperaturen 316 K. Den kinetiske energi bliver i det tilfælde 91 kJ. D.v.s. af de 352 kJ, den indre energi er forøget med, er de 212 kJ - 91 kJ = 121 kJ gået til at hæve temperaturen. Resten, altså 231 kJ, er at finde som vibrationer og rotationer. |
| RE: Adiabat 517-05-2023 17:41 | |
| John Niclasen★★★★★ (6434) |
Adiabat 5 I termodynamikken opererer man med begrebet entalpi (enthalpy på engelsk). Nogle vil måske kalde entalpi for den totale energi, hvor indre energi kun er en del af det. Vi havde udtrykket for den indre energi, U = Q + W, eller udtrykt ved ændringer, dU = dQ + dW. For en adiabatisk proces er ændringen i varme nul, så vi har dU = dW. På samme måde er der et udtryk for entalpi, og man benytter bogstavet H: H = U + p * V Entalpi, H, er altså den indre energi plus tryk gange volumen. (p * V)-leddet beskriver det arbejde, systemet har måtte udføre for at være til. Det koster noget at fylde noget ved et givet tryk. Vi kan nemt regne udtrykket (p * V) ud for de to situationer, jeg har beskrevet i denne serie om adiabat. I den ene situation ved 1 bar og en temperatur på 316 K er volumen af 1 kg atmosfære gas på Venus ca. 0.605 m3. Jeg får: p * V = 60.5 kJ (1 bar = 100 000 Pa, som er SI-enheden Pascal for tryk.) I den anden situation nede ved den faste overflade er trykket 92 bar og temperaturen 737 K. Volumen er i denne situation 0.015 m3 eller godt 15 liter. Jeg får: p * V = 141 kJ Hvis gas bevæger sig oppe fra 1 bar ned til 92 bar, så koster det altså ca. 80.5 kJ mere at være til: 141 kJ - 60.5 kJ = 80.5 kJ Hvor kommer de 80.5 kJ fra? Der var jo balance i udtrykket for termodynamikkens 1. lov for en adiabatisk proces, så arbejdet på ca. 352 kJ gik til at forøge den indre energi med samme ca. 352 kJ. Svaret finder man ved at kigge på dette gennem mekanikkens briller. De 1 bar og 316 K findes på Venus i en højde af knap 50 km. (Eller mere korrekt: jeg har regnet det ud til at være knap 50 km i mit ideale adiabatiske eksempel. Mere præcist 49 662 meter. Virkeligheden er lidt mere kompliceret, og man kan bruge resultaterne her til at sammenligne med virkeligheden.) Men 1 kg gas i knap 50 km højde har jo mere potentiel energi end 1 kg gas nede ved den faste overflade. Denne potentielle energi er omsat til anden form for energi, idet den 1 kg gas under adiabatiske forhold har bevæget sig de knap 50 km ned i tyngdefeltet i mit eksempel. Formlen for ændring i potentiel energi er: dE_pot = m * g * dz , hvor m er massen (1 kg), g er tyngdeaccelerationen, og dz er ændringen i højde. Jeg regner ændringen i potentiel energi ud til knap 437 kJ. Ændringen i indre energi er ca. 352 kJ. Ændringen i (p * V) fra udtrykket for entalpi er ca. 80.5 kJ. Dette giver tilsammen en ændring i energi på 352 kJ + 80.5 kJ = 433 kJ, altså det samme som ændringen i potentiel energi, når man ser bort fra den lille forskel, der skyldes usikkerhed på de forskellige værdier, f.eks. for varmekapaciteten. Energi-regnskabet passer! Ser man på det termodynamisk, er der balance mellem ændringen i indre energi og det arbejde, omgivelserne udfører på den 1 kg gas. Ser man på det med mekanikkens briller, så er der balance mellem ændringen i potentiel energi og ændringen i entalpi, der er summen af indre energi og (p * V), som er den energi, der koster af være til med volumen, V, når trykket er p. -------- Denne model, jeg har beskrevet, kan benyttes til at regne på planetatmosfærer opvarmet oppefra. Det gælder for Venus, Jupiter, Saturn, Uranus, og Neptun. For Venus kan man sige, at energien fra Solen afsættes højt i atmosfæren, hvor temperaturen er 2-300 K. Gas ændrer temperatur, når det bevæger sig lodret i et tyngdefelt. Dette gør, at temperaturen bliver 737 K nede ved den faste overflade på Venus. Det er ikke nødvendigt med nogen ekstra energikilde. Jo mere atmosfære, en planet har, jo længere er der fra højden med planetens effektive temperatur og den faste overflade, og jo højere vil temperaturen derfor være ved den faste overflade. Når dette er forstået kan man begynde at se på, hvad der er årsagen til, at f.eks. 0.1 bar findes i den højde, den gør. |
| 17-05-2023 18:40 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Adiabat 1 This post is full of errors. It is guaranteed to lead to incorrect math calculations. John Niclasen skrev:For at beskrive en adiabatisk process, så tager man fat i loven om energibevarelse. Og vi skal have fat i den udgave, man benytter i termodynamikken kaldet termodynamikkens 1. lov: Den korrekte formel for termodynamikkens 1. lov (bevarelse af energi) er E(t) = E(t+1), idet man bemærker, at energien af E(t+1) kan være af en anden form end E(t) ) . Ud fra dette kan vi udlede den formel, du nævnte: E(t) = udført arbejde(t+1) + termisk energi(t+1) The correct formula for the 1st law of thermodynamics (conservation of energy) is E(t) = E(t+1), noting that the energy of E(t+1) can be of a different form from E( t) ) . From this we can derive the formula you mentioned: E(t) = work done(t+1) + thermal energy(t+1) John Niclasen skrev:Den siger, at ændringen i energi, U, er lig ændringen i varme, Q, plus ændringen i arbejde, W, omgivelserne udfører på systemet. Det er her din beslutning om at forblive uvidende om emnet ugyldiggør alt, hvad du skriver fra dette tidspunkt fremad. Du nægtede at lære, hvad varme er. Du tænkte, at det ikke var nødvendigt at lære, hvad varme er. Du ville ikke lære, hvad varme er. Ikke desto mindre misbruger du udtrykket "varme" i hele dette og efterfølgende indlæg, hvilket gør dem ugyldige. I dette citat ovenfor bruger du fejlagtigt "varme" til at betyde "termisk energi." De er ikke ens. Termisk energi er energi og måles i Joule. Varme er noget helt andet og måles i kraftenheder, f.eks. Watt. This is where your decision to remain ignorant of the topic invalidates everything you write from this point forward. You refused to learn what heat is. You thought it wasn't necessary to learn what heat is. You wouldn't learn what heat is. Nevertheless, you misuse the term "heat" throughout this and subsequent posts, rendering them invalid. In this quote above, you mistakenly use "heat" to mean "thermal energy." They are not identical. Thermal energy is energy and is measured in Joules. Heat is something completely different and is measured in power units, e.g. Watts. |
| 17-05-2023 19:08 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:Adiabat 4 Hele denne tankegang er absurd. Det hele er forkert. Du hævder, at tyngdekraften skaber energi ved at holde atmosfæren på et vist tryk. Der udføres ikke noget arbejde. Din fejl er i den ideelle gaslov. Ændringer i temperatur og tryk er øjeblikkelige. Ergo skete temperaturstigningen engang i fortiden, da planeten/atmosfæren blev dannet...og så afkølede den hurtigt til planetens ligevægtstemperatur. Temperaturen forblev der. Tyngdekraften er ikke energi og tyngdekraften er ikke arbejde. Tyngdekraften er en kraft. Atmosfærens tryk skaber ikke energi og øger ikke temperaturen. Der var en idiot (Pete Rogers), der argumenterede for dette på den engelske Mirror-side, og det var en religion for ham. Dine fem indviklede indlæg er spild af båndbredde. This whole line of thinking is absurd. It's all wrong. You claim that gravity creates energy by keeping the atmosphere at a certain pressure. There is no work being performed. Your mistake is in the ideal gas law. Changes in temperature and pressure are instantaneous. Ergo, the rise in temperature happened sometime in the past when the planet/atmosphere formed...and then it quickly cooled to the planet's equilibrium temperature. The temperature remained there. Gravity is not energy and gravity is not work. Gravity is a force. The pressure of the atmosphere does not create energy and does not increase the temperature. There was an idiot (Pete Rogers) who argued this on the English Mirror site and it was a religion to him. Your five convoluted posts are a waste of bandwidth. |
| 17-05-2023 21:23 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: Hvis der med E(t) menes en mængde energi (til en given tid, t), så er det ikke samme formel, som jeg angiver. Min formel med dU er et differentiale med infinitesimale ændringer. I dette citat ovenfor bruger du fejlagtigt "varme" til at betyde "termisk energi." Man kan tilføre varme eller opvarme (heat transfer or heating). dQ er en energiændring. Energiændringen dQ defineres som varme, så min formulering kan misforstås og er dermed ikke perfekt. "Termisk energi" kan måles med et termometer, korrekt? Dermed er den termiske energi kun en del af energiændringen, da energi også går til rotation og vibration af molekyler. Termisk energi er kun den del, der går til translation af molekyler. Nogle gasser opnår en anden temperaturændring ved samme opvarmning (samme energiændring), end andre gasser, fordi de har en anden varmekapacitet. Varme er noget helt andet og måles i kraftenheder, f.eks. Watt. Varmetransport har enhed af f.eks. Watt. Jeg omtaler ikke varmetransport. Tilknyttet billede: 
Redigeret d. 17-05-2023 21:32 |
| 18-05-2023 06:48 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:IBDaMann skrev: Det er den samme ligning. Din "differentiering" er en mængde energi. Mængden af energi skal forblive den samme, selvom den kan være i forskellige former. It's the same equation. Your "differential" is an amount of energy. The amount of energy must remain the same, although it can be in different forms. John Niclasen skrev:IBDaMann skrev:I dette citat ovenfor bruger du fejlagtigt "varme" til at betyde "termisk energi." 1. Du kan ikke have varme i din ligning. Alle komponenter skal være energi. Du tilføjer energi for at vise, at mængden er den samme, og at energi bevares. 2. Den energi, der øger temperaturen, er termisk energi. Termisk energi er energi og måles i Joule. Det måles ikke med et termometer. 3. Et termometer måler temperatur, som ikke er termisk energi. Temperatur skyldes termisk energi over masse. 4. Varme er ikke energi. Varme (og køling) er strømme af termisk energi til eller fra en krop af stof og måles i effektenheder, såsom watt. Bemærk: Jeg bruger en oversætter. Udtryk kan være forkert oversat. Jeg inkluderer den originale engelske 1. You can't have heat in your equation. All components must be energy. You add energy to show that the amount is the same and that energy is conserved. 2. The energy that increases temperature is thermal energy. Thermal energy is energy and is measured in Joules. It is not measured with a thermometer. 3. A thermometer measures temperature, which is not thermal energy. Temperature is due to thermal energy over mass. 4. Heat is not energy. Heat (and cooling) are streams of thermal energy to or from a body of matter and are measured in units of power, such as watts. Note: I am using a translator. Terms may be incorrectly translated. I am including the original English. |
| RE: Check the model18-05-2023 09:33 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: I am full aware of that, and it works both ways. When you write "kraftenheder" in danish, you try to translate "power units", but "kraftenheder" means "force units" (so in units of Newton, which is completely wrong), and I was aware of your problem with translation. You use crappy google translation. You make this error again and again, when you comment here on the danish site, and that's why you get so many things wrong, that people write, and the consequence is, many of your comments are far out and beside the points. You write: This post is full of errors. It is guaranteed to lead to incorrect math calculations. You are wrong! My formula is correct: dU = dQ + dW As dQ is zero in an adiabatic process, we have: dU = dW , and I go on from there. I will not continue writing in english here, as this is a danish site, and while many danes are good at english, some are not and prefer danish. So I suggest to you (remember: this is just a suggestion), that you take a look at my paper in english describing this model to calculate on atmospheres heated from above. The paper has step by step instruction, how to use this model: The Lapse Rate Atmospheric Model @ researchgate.net I developed this model when studying at Niels Bohr Institute, University of Copenhagen. I wrote about it in 2016 in this post: The Lapse Rate Atmospheric Model 03-09-2016 21:41 And remember: this is just a model. A scientific way to test a model, is to compare its results with measurements from the real world. |
| 18-05-2023 18:25 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:You are wrong! My formula is correct: Jeg har ret. Jeg skrev at din formel er korrekt. Jeg omskrev simpelthen din ligning fra [dU = dQ + dW] til [E(t) = termisk energi(t+1) + udført arbejde(t+1)] Glem alt om ovenstående. Problemet i din argumentation er dit forsøg på at krænke termodynamikken ved at skabe energi ud af ingenting. Du gør dette ved forkert at hævde, at en øjeblikkelig atmosfærisk ændring, der skete (og fuldført) i fortiden, faktisk er i gang. Du tilføjer forkert en mængde energi (udført arbejde), og skaber energi ud af ingenting. Dette er åbenbart i modstrid med termodynamikken. Du hævder, at atmosfæren på en eller anden måde virker, fordi atmosfæren har et pres, men der bliver ikke gjort noget. _________ I am right. I wrote that your formula is correct. I simply rewrote your equation from [dU = dQ + dW] to [E(t) = thermal-energy(t+1) + work-done(t+1)] Forget about the above. The problem in your argument is your attempt to violate thermodynamics by creating energy out of nothing. You do this by incorrectly claiming that an instantaneous atmospheric change that happened (and completed) in the past is actually ongoing. You are incorrectly adding an amount of energy (work done), creating energy out of nothing. This is obviously contrary to thermodynamics. You claim that the atmosphere somehow works because the atmosphere has a pressure, but no work is done. _________ Bemærk: Du har fuldstændig ret. Jeg bruger Google Translate. Hvis du kender en bedre (gratis) oversætter, så lad mig det vide. Note: You are absolutely right. I'm using Google Translate. If you know of a better (free) translator, please let me know. |
| RE: Thermal energy18-05-2023 19:15 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: You introduce thermal energy. Can you define and/or describe thermal energy? Anyway, this term is zero, so we end with: dU = dW You make a big deal out of something, that vanish from the formula at the start. Your focus on this makes it less likely, that you would get anything from this model of mine. You write things like: It is guaranteed to lead to incorrect math calculations. and later: It's all wrong. I pointed you to a paper about the model in English. Did you read it? The problem in your argument is your attempt to violate thermodynamics by creating energy out of nothing. I see this as a false claim from you. I make a deal out of accounting for all energy, if you read carefully, what I write. Can you point me to, where energy is created out of nothing in my text? Redigeret d. 18-05-2023 19:37 |
| 18-05-2023 19:43 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:IBDaMann skrev: Selvfølgelig. Kun stof kan have temperatur. Termisk energi er den energi, der giver stoffet dets temperatur. Alt stof har temperatur og udstråler termisk (elektromagnetisk) ifølge Stefan-Boltzmann-loven. Termisk energi er energi og måles i Joule. Elektromagnetisk energi absorberet af stof omdannes til termisk energi og øger stoffets temperatur. ------- Of course. Only matter can have temperature. Thermal energy is the energy that gives matter its temperature. All matter has temperature and radiates thermally (electromagnetically) according to the Stefan-Boltzmann law. Thermal energy is energy and is measured in Joules. Electromagnetic energy absorbed by matter is converted into thermal energy and increases the matter's temperature. |
| 18-05-2023 20:24 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev:John Niclasen skrev:IBDaMann skrev: I agree. All matter has temperature and radiates thermally (electromagnetically) according to the Stefan-Boltzmann law. Yes, with or without an emissivity factor. (Without for black-body.) Thermal energy is energy and is measured in Joules. Electromagnetic energy absorbed by matter is converted into thermal energy and increases the matter's temperature. Not all of the energy, right? If the matter consists of molecules, that can also rotate and vibrate, some of the electromagnetic energy goes to rotation and vibration, which is not thermal energy. Back to the formula, you made a big deal out of. dQ is zero, but let's finish this for cases, where dQ is not zero and therefore is needed. It is important to define dQ. I have several sources. Enrico Fermi writes: See attached image. But his is Q, not dQ. Later Fermi introduces a version of the formula with infinitesimal versions of (inner) energy, work, and Q, therefore dQ. What shall dQ be known as in your opinion? Tilknyttet billede: 
Redigeret d. 18-05-2023 20:26 |
| 19-05-2023 07:53 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:(Without for black-body.) For at forhindre misforståelser senere, lad os definere udtryk korrekt: Sort krop: et legeme af stof, der udstråler termisk. Alle stoflegemer er sorte kroppe. Ideal (eller Perfekt) Sort krop: en sort krop af emissivitet = 1,0; Dette er en teoretisk øvre grænse, og ingen eksisterer faktisk i naturen. Alt stof udstråler termisk, er Stefan-Boltzmann-loven. Alt betyder noget, altid, overalt. To prevent misunderstandings later, let's correctly define terms: Black Body: a body of matter that is radiating thermally. All bodies of matter are black bodies. Ideal (or Perfect) Black Body: a black body of Emissivity = 1.0; this is a theoretical upper limit and none actually exist in nature. All matter radiates thermally, er the Stefan-Boltzmann law. All matter, always, everywhere. John Niclasen skrev:Not all of the energy, right? If the matter consists of molecules, that can also rotate and vibrate, some of the electromagnetic energy goes to rotation and vibration, which is not thermal energy. Hvis du vil bruge Black Body videnskab, er der kun to muligheder for termisk stråling: 1) absorberet og 2) reflekteret. Emissivitetsværdien af et sort legeme er procentdelen af indfaldende termisk stråling, der absorberes under hensyntagen til alle bølgelængder. Resten afspejles. Black Body videnskab tilbyder ingen andre muligheder. If you want to use Black Body science, there are only two options for thermal radiation: 1) absorbed and 2) reflected. The emissivity value of a black body is the percentage of incident thermal radiation that is absorbed taking into account all wavelengths. The rest is reflected. Black Body science offers no other options. John Niclasen skrev:Back to the formula, you made a big deal out of. dQ is zero, but let's finish this for cases, where dQ is not zero and therefore is needed. It is important to define dQ. (I apologize but I can't put Dansk in this section) No, it is not important to define dQ. You are missing the point and you are making this far more complicated than it should be. Let's start at the beginning. Energy is always conserved. Energy can change forms forever, but the total quantity always remains the same. Ergo: Energy(time T) = Energy(time T+1) ... and I don't have to define which energy or what form because this is always TRUE. If we decide we wish to specify that some energy was converted into work and thermal energy, we must always acknowledge that the total quantity remains the same, and thus we write: * Energy(initial) = work(final) + thermal_energy(final) Notice that I do not need to specify the type(s) of initial energy. If no thermal energy is produced, i.e. thermal_energy(final)= 0 then * Energy(initial) = work(final) If the Energy(initial) is not the total energy of the system, then we can write: * Total_Energy(time T) = Total_Energy(time T+1) + work_accomplished From here you can perform all the algebra you wish. You can define a "differential" if you wish that equals work_accomplished + thermal_energy_produced, i.e. * Differential = work_accomplished + thermal_energy_produced Just remember that you always need to account for all of the energy, and you must ensure that whenever energy changes forms, no energy is ever created or destroyed. If you define the Differential in this way, you will have to subtract the amount of thermal_energy_produced from the Total_Energy to ensure you are not duplicating energy and thus creating energy. John Niclasen skrev:I have several sources. Gode nyheder. Det betyder ikke noget, hvad andre siger. Alt, hvad der siges af andre, skal overholde termodynamikken og skal derfor sige præcis, hvad jeg skrev ovenfor. Du kan gøre hvad algebra du vil. Hvis du overholder termodynamikens 1. lov, vil du være korrekt. Bare sørg for at gøre matematikken korrekt. Good news. It doesn't matter what others say. Everything that is said by others must adhere to thermodynamics, and therefore must say exactly what I wrote above. You can do whatever algebra you want. If you adhere to the 1st law of thermodynamics, you will be correct. Just make sure you do the math correctly. |
| 19-05-2023 09:21 | |
| John Niclasen★★★★★ (6434) |
@ IBDaMann The text "All matter radiates thermally, er the Stefan-Boltzmann law. All matter, always, everywhere." is translated by the crappy google translate to "Alt stof udstråler termisk, er Stefan-Boltzmann-loven. Alt betyder noget, altid, overalt." The last sentence in danish means: "Everything means something, always, everywhere." You shouldn't use that crappy translation! You make this mistake again and again. I and other Danes have to learn english to communicate in english. You should learn danish, if you want to communicate in danish. If you don't know danish, you shouldn't try to communicate in danish. I see no other way, and I don't know of any other translation, that can accomplish, what you are trying. If you write in English, others can understand (if they understand English, as many Danes do), or they can translate (with crappy google or something). |
| 19-05-2023 09:24 | |
| John Niclasen★★★★★ (6434) |
IBDaMann writes: You seem to contradict yourself, as you wrote earlier: In this quote above, you mistakenly use "heat" to mean "thermal energy." At that time, it seems very important to you to define the terms. And you used that to attack. In the formula in the Fermi text: Delta U + L = Q , Fermi defines Q this way: By definition, we shall now call Q the amount of heat received by the system during the transformation. Question: Do you agree, that what Fermi calls "amount of heat received", you call "thermal energy"? In other words, you are not in agreement with Fermi? The words used are less important than the science. I share this view with Richard Feynman and others (maybe you?). And this is a problem here, as you write: "Thermal energy is the energy that gives matter its temperature.". Let's take a situation without work, so that term is zero. If you heat 1 mol of helium with an amount, Q, and you heat 1 mol of carbon dioxide with the same amount, Q, the change in temperature will not be the same for the two situations, because of the difference in molar heat capacity. Question: Isn't it wrong then to call Q for "thermal energy"? |
| 19-05-2023 20:23 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:You seem to contradict yourself, as you wrote earlier:In this quote above, you mistakenly use "heat" to mean "thermal energy." Dette er forskellen: Da mængden af energi altid skal bevares, skal energitypen ikke specificeres. E(Tid T) = E(Tid T+1) er altid sandt, uanset hvilken eller hvilke former for energi der er tale om. Det er lige meget, hvad du kalder variablerne. På den anden side er varme ikke energi. Du forsøgte at bruge forskellige udtryk i flæng, på trods af deres forskellige måleenheder. Dette resulterede i, at du forsøgte at tilføje energi til magten. Varme er ikke en type energi. Arbejde og energi måles begge i Joule (energienheder), mens varme måles i watt (effekt). Du kan ikke tilføje arbejde til varmen. De har hver især forskellige enheder. This is the difference: Since quantity of energy must always be preserved, the type of energy does not need to be specified. E(Time T) = E(Time T+1) is always true, regardless of the form(s) of energy in question. It does not matter what you name the variables. On the other hand, heat is not energy. You tried to use different terms interchangeably, despite their different units of measure. This resulted in you trying to add energy to power. Heat is not a type of energy. Work and energy are both measured in Joules (energy units of measure) whereas heat is measured in watts (power). You can't add work to heat. They each have different units. John Niclasen skrev:Do you agree, that what Fermi calls "amount of heat received", you call "thermal energy"? In other words, you are not in agreement with Fermi? Jeg er uenig i formuleringen. Jeg skal se regnestykket, før jeg kan sige, om der er en fejl. Det er almindeligt at finde lærere, der misbruger ordet "varme", fordi de ikke tror, at deres publikum er i stand til at forstå formlen for varme (meget mindre konvektion), og at de sandsynligvis vil blive skræmt/forvirret af udtrykket "termisk energi." Det er derfor, Einstein brugte udtrykket "varme", når han underviste, men holdt energiformerne ved lige i sine modeller. I disagree with the wording. I must see the math before I can say whether there is an error. It is common to find teachers misusing the word "heat" because they don't believe their audiences are capable of grasping the formula for heat (much less convection) and that they will likely be intimidated/confused by the term "thermal energy." This is why Einstein used the term "heat" when teaching but kept the forms of energy straight in his models. John Niclasen skrev:The words used are less important than the science. Jeg er enig. Det er derfor, jeg er ligeglad med, hvad du kalder noget, undtagen når du blander forskellige måleenheder sammen. I agree. This is why I don't care what you call anything, except when you are conflating different units of measure. John Niclasen skrev: Ja, "Q" er termisk energi i dette tilfælde. "Q" er en mængde Joule, ikke Watt. Du var forkert at kalde det varme. Jeg anbefaler, at du ikke bruger "Q", men i stedet kalder variablen "termisk energi". Yes, "Q" is thermal energy in this case. "Q" is an amount of Joules, not Watts. You were incorrect to call it heat. I recommend you not use "Q" but instead call the variable "thermal energy". |
| 20-05-2023 09:31 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: The danish word for power as in e.g. political power is "magt". The danish word for power measured in Watt in physics is "effekt". In danish, it is nonsens, what you write. Learn danish or stop using crappy google translate and just write English. (It might not hold/is not preferred, as this is a danish site.) And this works both ways. Valid text with meaning in danish, you get translated to rubbish nonsens in English. And you don't possess the skills to figure it out, so you attack others here. Redigeret d. 20-05-2023 10:15 |
| 20-05-2023 09:56 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: Sure, energy is preserved. But I specifically wrote: For at beskrive en adiabatisk process, så tager man fat i loven om energibevarelse. Og vi skal have fat i den udgave, man benytter i termodynamikken kaldet termodynamikkens 1. lov: And you sabotage this try to communicate science to others. On the other hand, heat is not energy. You tried to use different terms interchangeably, despite their different units of measure. I absolutely did not. I am a scientist with university degrees in physics. I didn't make such mistake. This resulted in you trying to add energy to power. Again, absolutely not. I use common terms earlier used by scientists like Fermi. It is also in my danish material from university, where it reads: "Energiændringen dQ defineres som varme." It is a common definition used in scientific writing about thermodynamics. Heat is not a type of energy. Work and energy are both measured in Joules (energy units of measure) whereas heat is measured in watts (power). You can't add work to heat. They each have different units. Question: Can you point to other sources with this definition, or are you alone on that? I recommend you not use "Q" but instead call the variable "thermal energy". Q is fine and seems to be used widely by others too. What is worrying, is that you refer to this term as "thermal energy", and you at the same time define "thermal energy" as: The energy that increases temperature is thermal energy. This last sentence is in agreement with: "The average translational kinetic energy possessed by free particles given by equipartition of energy is sometimes called the thermal energy per particle." But Q is not only that, is it!? Molecules can have translation, rotation, and vibration, all adding to the heat capacity. "Thermal energy" is only the translation part. Q is a larger concept. I am pretty sure, you are wrong, when you say, the Q term is equal to thermal energy. ----- And all this is just side-notes, as dQ is zero in an adiabatic process. Redigeret d. 20-05-2023 10:35 |
| RE: Feynman writes20-05-2023 11:17 | |
| John Niclasen★★★★★ (6434) |
@ IBDaMann Richard Feynman as a source in this: Let us begin by stating the first law, the conservation of energy: if one has a system and puts heat into it, and does work on it, then its energy is increased by the heat put in and the work done. We can write this as follows: The heat Q put into the system, plus the work W done on the system, is the increase in the energy U of the system; the latter energy is sometimes called the internal energy: This again suggest, you may be alone in your definition of the concept of heat. Tilknyttet billede:  |
| 20-05-2023 22:27 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:@ IBDaMann, Richard Feynman as a source in this: Jeg undskylder for kun at skrive nedenstående indlæg på engelsk, og jeg sætter pris på din fleksibilitet. Google Translate fejloversætter fuldstændigt de tekniske udtryk. Jeg kan ikke få en god oversættelse. I apologize for writing the below post only in English and I appreciate your flexibility. Google Translate completely mistranslates the technical terms. I can't get a good translation. John Niclasen skrev: if one has a system and puts heat into it, This is incorrect wording. I don't care who is making this error, it is an error. We'll try some Dansk: Varme "sættes ikke i" et system; Varme "påføres" til et system. Termisk energi er det, der "sættes i" et system. "Varme" er, hvordan termisk energi kommer ind i eller forlader et system eller en krop af stof. --------- Heat is not "put into" a system; Heat is "applied" to a system. Thermal energy is what is "put into" a system. "Heat" is how thermal energy enters or leaves a system or body of matter. John Niclasen skrev:and does work on it, then its energy is increased by the heat put in and the work done. This is an error. The amount of work performed is subtracted from the previous total amount of energy. The amount of work done represents energy that was spent. Mængden af udført arbejde repræsenterer energi, der blev brugt[/ b]. The amount of work done represents energy that was [b]used. Energy(Initial) = Energy(Final) + Work_Performed (conservation of energy) ... ergo ... Energy(Initial) - Work_Performed = Energy(Final) John Niclasen skrev:This again suggest, you may be alone in your definition of the concept of heat. 1. Physics is not determined by consensus. Science is not the result of a democratic vote. 2. All engineers who build things involving "heat" use my definition. 3. You don't know what my definition of "heat" is because you don't know what the correct definition of "heat" is. I highly recommend you learn it. You will get more things correct when you do. |
| 20-05-2023 23:10 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev:John Niclasen skrev:and does work on it, then its energy is increased by the heat put in and the work done. I can then inform you, that there exists two sign conventions regarding the work term. One is where the term means work done by the system, the other where the term means work done on the system. This fact of two conventions is mentioned e.g. here: First Law of Thermodynamics @ hyperphysics.phy-astr.gsu.edu They write: ΔU = Q - W One is not more correct than the other. Both can be used to calculate the same. IBDaMann skrev: You make it impossible. It is not determined by consensus, but there is a correct definition!? Eh!?? It is just a definition. I prefer the definition used in physics, as I am a physicist. Ok, I don't think, we can progress any further regarding the Q term, so let's move on. It is zero anyway in an adiabatic process, that my whole atmosphere model is based on. Up earlier, just after my five "adiabatic" posts, you write: IBDaMann skrev: No, it is not. You may not be used to see science as us physicists formulate it. IBDaMann skrev: Absolutely not! Will you please point me directly to where I create energy out of nothing, as you claim. Then I will in return demonstrate for you, that I account for all energy, and that nothing is created nor destroyed. Energy is 100% preserved in my calculations. Tilknyttet billede: 
Redigeret d. 20-05-2023 23:13 |
| 22-05-2023 16:13 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:I can then inform you, that there exists two sign conventions regarding the work term. John, jeg forstår ikke hvorfor du fortsætter med at argumentere for denne ligning. Jeg bliver ved med at sige, at din ligning er korrekt. Jeg ved ikke, hvad du ellers vil have mig til at skrive. Termodynamikkens første lov kræver, at dine ligninger bevarer den samme mængde energi. Det er alt. Siger du, at en af mine ligninger ikke sparer energi? John, I don't understand why you continue to argue this equation. I keep saying your equation is correct. I don't know what else you want me to write. The first law of thermodynamics requires that your equations conserve the same amount of energy. That is all. Are you saying that one of my equations does not conserve energy? John Niclasen skrev:IBDaMann skrev: Det er her, du bliver hængende. Du ønsker ikke at lære, hvad varme er. Lad os gennemgå: * Du ved, at termisk energi er energi og måles i Joule. * Du ved, at arbejde er energiforbrug og måles i Joule. * Du ved, at termodynamik handler om energi, især bevarelse af energi. * Du ved, at varme ikke er energi, fordi den måles i Watt. * Du ønsker stadig at behandle varme som energi. Dette er din fejl. Jeg ved ikke, hvad jeg ellers skal sige. This is where you get stuck. You don't want to learn what heat is. Let's review: * You know that thermal energy is energy and is measured in Joules. * You know that work is energy consumption and is measured in Joules. * You know that thermodynamics is about energy, especially the conservation of energy. * You know that heat is not energy because it is measured in Watts. * You still want to treat heat as energy. This is your mistake. I don't know what else to say. John Niclasen skrev:Ok, I don't think, we can progress any further regarding the Q term, so let's move on. Tak skal du have. Din brug af "Q" er stadig korrekt. Thank you. Your use of "Q" is still correct. John Niclasen skrev:Will you please point me directly to where I create energy out of nothing, as you claim. Selvfølgelig. På Adiabat 4 ... skriver du: Of course. On Adiabat 4 ... you write: Adiabat 4 Intet arbejde udføres af den omgivende atmosfære. Dette er energi, som du skaber ud af ingenting. No work is done by the surrounding atmosphere. This is energy that you create out of nothing. |
| 22-05-2023 16:47 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: No, this is a fallacy, you produce. Don't misrepresent, what others write and understand. You keep doing that in many posts in replies to others as well. Do you do it on purpose, or are you incapable of seeing, what you do? If you keep producing this logical fallacy, I will put you on ignore again. In physics, heat is energy in units of e.g. Joules. You might not come from a background in natural sciences as physics and have another definition of heat. In physics we have heat transfer in power units, e.g. Watts (what you seem to call heat). IBDaMann skrev: It is just another definition. It is your mistake to not see that. It makes me think of a question to you long ago. Why do you hide behind a nickname? Why do you need that? You should use your real name, or if you don't wanna do that, then at least change your nick to IBNotDaMann. It will better suit, how you write. Redigeret d. 22-05-2023 17:28 |
| 22-05-2023 16:58 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: As described in posts previous to Adiabat 4, I look at an amount of gas at 1 bar high above the ground on Venus moving down to 92 bar. In Adiabat 1 I wrote: John Niclasen skrev: The English translation, so you have less chance of misreading, which I figure, you do a lot with your crappy google translate: "But if we move 1 kg of gas from 1 bar on Venus down to the surface, where there is 92 bar, then of course the pressure changes." 1 kg of gas has less volume at 92 bar than at 1 bar. The gas is compressed, like when you compress gas in a bicycle pump. With a bicycle pump, you do the work compressing the gas. In an atmosphere, the surrounding atmosphere do the work. At the same time, 1 kg of gas needs to raise from 92 bar up to 1 bar, expanding and therefore doing work on the surrounding atmosphere. It adds up so no energy is added or subtracted in total. The end situation is the same as the initial situation. 100% energy preservation. You can look at this thought example as a (idealised) case of convection. And it is done adiabatically without heating nor cooling. Redigeret d. 22-05-2023 17:06 |
| 22-05-2023 17:26 | |
| John Niclasen★★★★★ (6434) |
IBDaMann skrev: In much scientific literature, the terms black body and grey body (or US English: gray body) are used, where black body is the idealised example with emissivity 1. The Cosmic Background Radiation (CBR) is the best known example of radiation closest to the idealised black body radiation. You will have lots of trouble communicating with people, if you insists on definitions, that are not commonly used in the scientific litterature. In the end, definitions are less important. The science is more important. Redigeret d. 22-05-2023 17:27 |
| 22-05-2023 19:08 | |
| IBDaMann★★★☆☆ (999) |
John Niclasen skrev:You will have lots of trouble communicating with people, if you insists on definitions, that are not commonly used in the scientific litterature. Anyone not using the correct definitions as specified in the science models is the one causing the confusion. John Niclasen skrev:In the end, definitions are less important. The science is more important. I sidste ende er de videnskabelige modeller, som er definitionerne, alt. In the end, the scientific models, which are the definitions, are everything. |
Deltag aktivt i debatten Hvad fortæller Venus os om CO2 som drivhusgas på Jorden? IGEN !:
Lignende indhold
| Debatter | Svar | Seneste indlæg |
| Sammenligning: Jorden og Venus | 5 | 14-04-2020 23:40 |
| Hvad fortæller Venus os om CO2 som drivhusgas på Jorden? | 436 | 28-09-2016 22:29 |
| Klimaet på Venus og Jorden | 437 | 04-09-2016 13:34 |
| Venus - igen igen | 7 | 19-07-2013 22:11 |
| Metan fundet for let til at være en farlig drivhusgas | 3 | 02-08-2007 16:45 |
| Artikler |
| Ib Lundgaard Rasmussen: Klimaet på Venus - en løbsk drivhuseffekt? |
| Nyheder | Dato |
| 4 procent mere drivhusgas fra USA i 2020 | 03-06-2010 07:56 |
| USA vil skære udledningen af drivhusgas med 17 procent | 25-05-2009 09:57 |
| Nu kan amerikanerne lovgive om drivhusgas | 20-04-2009 06:22 |
| Fladskærme udleder kraftig drivhusgas | 31-10-2008 11:18 |
| Ny drivhusgas i kraftig stigning | 24-10-2008 16:53 |